Fransk/dansk samarbejde afslører nye aspekter i immun-regulering
Et frugtbart samarbejde mellem et forskerteam fra Institut for Biomedicin, Aarhus Universitet, Neurologisk afdeling, Aarhus Universitetshospital samt et forskerteam fra Institut Pasteur i Paris har påvist, at en epigenetisk reguleringsmekanisme er fælles for elementer i menneskets immunforsvar og for visse humane endogene retrovirus.
Skrevet af: Lektor Tove Christensen
Et frugtbart samarbejde mellem et forskerteam fra Institut for Biomedicin ved Aarhus Universitet og Neurologisk afdeling, Aarhus Universitetshospital, og et forskerteam fra Institut Pasteur i Paris, har påvist at en epigenetisk reguleringsmekanisme er fælles for elementer i menneskets immunforsvar og for visse humane endogene retrovirus. Med disse resultater håber forskerne blandt andet at vise nye veje for behandling af multipel sklerose.
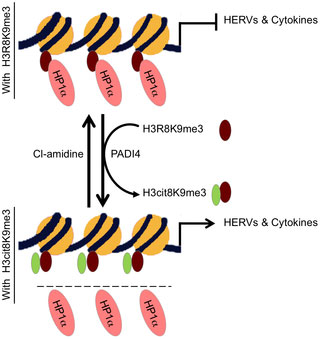
Epigenetik omfatter de mekanismer, som regulerer geners udtryk. Denne regulering vedrører ikke DNA i sig selv, men derimod den information som beror i kromatinet – den overordnede organisation af DNA i cellen. Denne organisation styres af en række forskellige proteiner, blandt andre HP1. Dr. Christian Muchardt fra Institut Pasteur er en førende ekspert i HP1s epigenetiske funktion.
Lektor Tove Christensen og lektor Anné Møller-Larsen fra Institut for Biomedicin, Medicinsk Mikrobiologi og Immunologi, har sammen med overlæge Thor Petersen, som leder Skleroseklinikken på Neurologisk afd., Aarhus Universitetshospital, i en årrække studeret humane endogene retrovirus – HERVs – mulige rolle i den immun-medierede neurologiske sygdom multipel sklerose (MS).
MS er en kompleks neurodegenerativ sygdom og den hyppigst forekommende neurologiske sygdom i vores del af verden. Man kender endnu ikke årsagerne til MS; formentlig er der et samspil mellem genetiske og miljømæssige faktorer. Hos patienter med MS er nogle af de hvide blodceller over-aktive; de danner alt for store mængder af forskellige inflammatoriske signalstoffer og blandt andet angribes myelin-skederne om nervecellerne, således at nervesignalerne ikke fungerer som de skal.
HERV er rester af evolutionært gamle retrovirusinfektioner, integreret i vores DNA; og de er normalt inaktive.HERV er både er en del af vores genom (og kan derfor bidrage til genetisk susceptibilitet) og kan efter aktivering på mange måder opføre sig som virus. Aarhus-forskerne har vist, at der er en specifik association mellem HERVs og MS: sammenligner man MS patienter med kontrolpersoner kan aktiverede HERV påvises i blodet hyppigere hos MS patienter end hos kontroller. Aarhus-forskerne har også vist, at udtrykket af HERV på blodceller er særligt opreguleret hos MS patienter med aktiv sygdom og at immunresponset mod HERV (både humoralt og celle-medieret) er tæt forbundet med sygdomsaktivitet.
I fælleskab har forskerne bag det nye studie undersøgt om der er en sammenhæng mellem aktiveringen af de inflammatoriske signalstoffer og aktiveringen af HERV hos MS patienter – og det er nu lykkedes at vise, at der er en sammenhæng: i ”raske” celler nedreguleres genudtrykket for både inflammatoriske signalstoffer og HERV af den samme faktor: HP1. I celler fra MS patienter binder HP1 ikke på samme måde som hos raske og derfor fungerer nedreguleringen ikke. En detaljeret undersøgelse af celler fra en undergruppe af MS patienter viste, at ødelæggelsen af HP1-bindingen skyldes PADI4(peptidyl arginine deiminase, type IV), et enzym som også kan være impliceret i andre autoimmune sygdomme. Disse fund kan vise nye veje for behandling af MS, idet PADI4- inhibitorer måske kan reducere aktiviteten i de over-aktive blodceller.
Studiet er publiceret i det ansete tidsskrift PLoS Genetics