Forskningsgennembrud baner vej for forståelse af alvorlige sygdomme
Ny grundforskning afdækker, hvordan kroppens celler transporterer fedt. Defekter i mekanismen kan føre til alvorlige neurologiske sygdomme, leversygdom og ufrivillig barnløshed, og den nye viden er et vigtigt skridt på vejen til at forstå og behandle sygdommene.
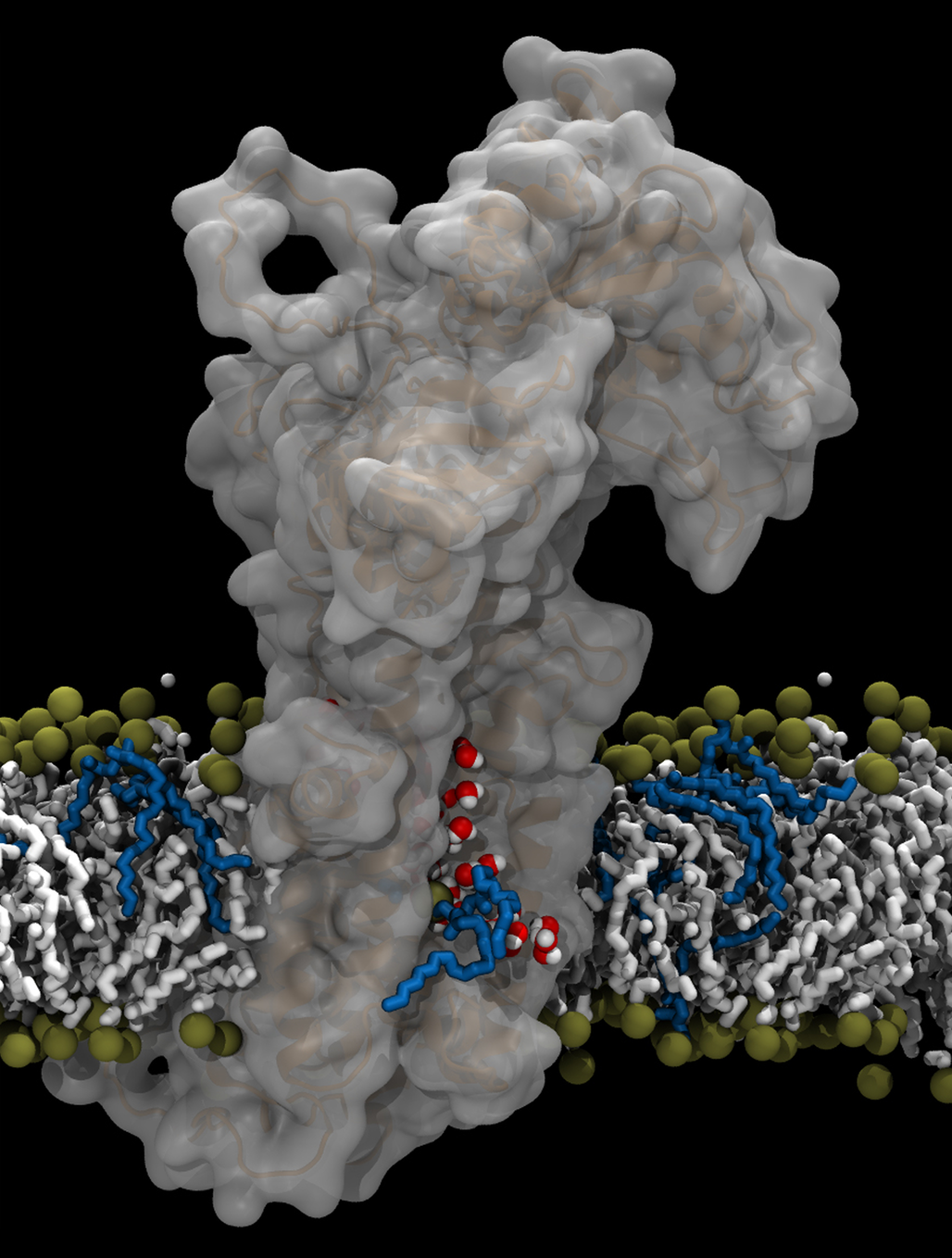
For nogle år siden beskrev forskere en tyrkisk familie, hvis familiemedlemmer gik på alle fire. Det viste sig, at de manglede ligevægtssansen. Årsagen var den sjældne neurologiske sygdom CAMRQ, som skyldes en mutation i en fedtpumpe i cellerne. Til gengæld vidste man ikke, hvorfor den genetiske fejl fik så alvorlige konsekvenser.
Fundet gav inspiration til et dansk studie af mekanismen for den livsvigtige fedtpumpefunktion, den såkaldte flippase, som flytter fedtstoffer i den membran, der omgiver hver eneste celle i kroppen. Nu har forskere fra Aarhus Universitet fremsat en hypotese, som forklarer, hvordan flippasen fungerer og har dermed fundet svaret på et grundforskningsmæssigt spørgsmål, som har optaget forskere i årevis. Studiet er blevet publiceret i det anerkendte, videnskabelige tidsskrift PNAS.
Grundlæggende spørgsmål for forskere verden over
Der findes 14 forskellige typer flippaser i cellerne. De danske forskere har i samarbejde med kolleger i Schweiz og Canada opstillet en model for, hvordan fedtmolekylerne bevæger sig imellem de to lag i cellemembranen. Modellen er udarbejdet ved, at forskerne i laboratoriet har efterlignet mutationen hos den tyrkiske familie på en af flippaserne - den såkaldte ATP8A2 - og via computersimulationer har studeret flippasens strukturændringer.
”Med modellen har vi fundet et muligt svar på det spørgsmål, der kaldes ’the giant substrate problem’. Man har aldrig tidligere kunnet forklare, hvordan et forholdsvist lille protein er i stand til at flytte store fedtmolekyler i membranen. Dette grundlæggende spørgsmål har optaget forskere over hele verden, siden flippaseproteinets eksistens og størrelse blev kendt. Med den nye viden kan vi forstå, hvordan mutationen griber ind i fedttransportmekanismen og derved fremkalder sygdom” fortæller postdoc Anna Lindeløv Vestergaard, som er en af forskerne bag projektet.
Forskningen baseret på dansk Nobelpris-forskning
Studiet er baseret på den forskningstradition, som nobelprismodtager Jens Christian Skou lagde grunden til, da han i 1950’erne som den første opdagede en pumpefunktion i cellerne, den såkaldte natrium-kalium-pumpe.
Flippasen og natrium-kalium-pumpen tilhører en gruppe af i alt 36 forskellige pumpeproteiner, som findes i cellemembranerne i kroppens celler. Pumperne er livsvigtige, og genetiske fejl i flippaser er - foruden den tyrkiske families sygdom - medvirkende til den dødelige leversygdom Bylers sygdom, ufrivillig barnløshed og neurologiske sygdomme som f.eks. Alzheimers sygdom.
”Ud af cellernes 36 pumper er 14 af dem flippaser. Alene af den årsag er der grund til at tro, at de spiller en vigtig rolle. Genetiske fejl i flippaserne er formentlig årsag til langt flere sygdomme, end vi ved i dag. Den grundvidenskabelige forståelse er første skridt på vejen og kan på sigt føre til, at man bedre kan diagnosticere og behandle sygdomme, som skyldes fejl i en flippase,” siger postdoc Anna Lindeløv Vestergaard og fortsætter:
”Den nye viden kan også bruges til udvikling af ny medicin, da flippaser også kan transportere fedtopløselig medicin. Når vi ved, hvordan medicin kan komme ind i cellen, kan den designes, så behandlingen bliver mere målrettet og virkningsfuld.”
Vigtigt skridt til større viden
Flippaserne sørger for, at der er asymmetri mellem de to fedtlag i cellemembranen, så membranen krummer, hvilket er nødvendigt, for at cellerne kan dele sig eller smelte sammen. Derfor har flippaserne også betydning under f.eks. fosterudvikling, befrugtning og hormonudskillelse fra cellerne til blodet.
”Vi formoder, at den grundlæggende mekanisme, vi har opdaget, er universel for alle flippaser i mennesker og dyr. Så dette er første skridt til en langt større viden, end vi har i dag,” siger professor Jens Peter Andersen, som har ledet studiet i samarbejde med Anna Lindeløv Vestergaard.
Om flippaser og ’the giant substrate problem’
- ATP8A2 tilhører en proteinfamilie, der kaldes flippaser.
- Flippaser ”flipper” bestemte fedstoffer mellem de to lag i cellemembranen og fungerer altså som fedtpumper.
- Forskere har hidtil ikke kunnet forklare, hvordan et forholdsvist lille protein er i stand til at flytte store fedtmolekyler i membranen, hvilket også er blevet kaldt ’the giant substrate problem’.
- De aarhusianske forskeres model viser, hvordan ’hovedet’ af fedtmolekyler bevæger sig gennem en kanallignende åbning i ATP8A2 proteinet mellem de to lag i cellembranen, mens ’halen’ glider i det omkringliggende fedt, hvorved det kan lade sig gøre at det store fedtmolekyle kan flytte sig.
- ATP8A2 findes bl.a. i nervecellerne i lillehjernen, hvor dets funktion er afgørende for udviklingen af ligevægtssansen.
Læs mere
Læs hele den videnskabelige artikel i PNAS ”Critical roles of isoleucine-364 and adjacent residues in a hydrophobic gate control of phospholipid transport by the mammalian P4-ATPase ATP8A2”
Yderligere oplysninger
Postdoc Anna Lindeløv Vestergaard
Aarhus Universitet, Institut for Biomedicin
Direkte telefon: 8716 7282
Mobil: 2657 0839
alve@fi.au.dk
Professor Jens Peter Andersen
Aarhus Universitet, Institut for Biomedicin
Direkte telefon: 8716 7725
Mobil: 2043 4362
jpa@fi.au.dk